- Inicio
-
TIENDA
add remove
Categorías
add remove- Salud add remove
- Accesorios add remove
- Juguetes add remove
- Entrenamiento
- Otras especies
- Vestimenta
- Alimento add remove
Legales
add remove - Acerca
- Contacto
DOXIMED 30
Referencia: 522920
- Write a review
Your comment is submitted

16 otros productos en la misma categoría:
CORTAVANCE
DESCRIPTION
CORTAVANCE
Familias : Animales de Compañía
Lineas : Dermatológicos
DESCRIPCIÓN:
CORTAVANCE® incorpora Hidrocortisona Aceponato (HCA), un innovador corticosteroide indicado en el tratamiento de prurito e inflamación causada por dermatosis en perros.
CORTAVANCE
Reg. SAGARPA Q-0042-353
USO VETERINARIO
Solución cutánea para uso en perros
PRESENTACIÓN: Frasco de 76 ml
FÓRMULA:
Cada 1 ml contiene:
Hidrocortisona Aceponato………………….. 0.584 mg
Vehículo c.b.p……………………….………………1 ml
INDICACIONES:
Para el tratamiento de prurito e inflamación causado por dermatosis en perros.
VÍA DE ADMINISTRACIÓN:
Tópica cutánea.
DOSIS:
CORTAVANCE® se aplica pulsando el atomizador a una distancia de unos 10 cm de la zona a tratar. La dosis recomendada es de 1.52 μg de hidrocortisona aceponato/cm2 de piel afectada al día.
Esta dosis puede obtenerse con dos pulsaciones del atomizador sobre la superficie a tratar equivalente a un cuadrado de 10 cm x 10 cm. Repetir el tratamiento diariamente durante 7 días consecutivos.
La superficie corporal total tratada no debe exceder de un área correspondiente, p.e., a un tratamiento de los dos costados, desde el lomo hasta las cadenas mamarias, incluidos los hombros y los muslos.
Recomendaciones y forma de uso:
No pulverizar en los ojos del animal. Presentado como un spray volátil, este medicamento no requiere masaje.
En el caso de enfermedad microbiana concurrente o de infestación parasitaria, el perro deberá recibir el tratamiento apropiado. El uso en gestantes, lactantes, menores de 7 meses y animales con el síndrome de Cushing debe basarse en la evaluación del beneficio/riesgo
Sobredosificación:
A las dosis terapéuticas recomendadas y el doble del tiempo recomendado, no se observaron efectos sistémicos.
Contraindicaciones:
No usar en úlceras cutáneas.
ADVERTENCIAS:
En caso de contacto accidental con la piel, se recomienda lavar con abundante agua. Lavar las manos después del uso. Evitar el contacto con los ojos. En caso de contacto accidental con los ojos, lavar con agua abundante. En caso de irritación ocular, consultar al médico. En caso de ingestión accidental, consulte con un médico inmediatamente y muéstrele el texto del envase o el prospecto.
Pulverizar preferentemente en un lugar ventilado. Inflamable. No pulverizar sobre llama o cualquier material incandescente. No fumar mientras se manipula el producto veterinario. Interacciones: en ausencia de información, se recomienda no aplicar otras preparaciones tópicas al mismo tiempo sobre las mismas lesiones.
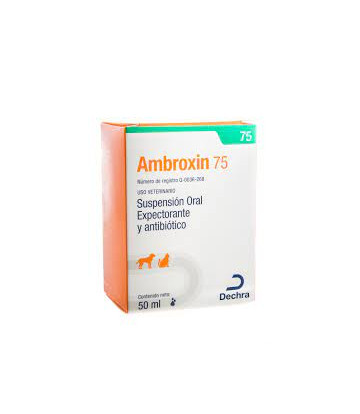
AMBROXIN 75
DESCRIPTION
FORMULA :
Cada ml contiene:
Amoxicilina Trihidratada ... 75 mg
Bromhexina Clorhidrato .... 2.5 mg
Excipiente c.b.p. ............ 1 ml
Expectorante con antibiótico indicado para el tratamiento de infecciones de las vías respiratorias causadas por bacterias grampositivas y gramnegativas sensibles a la amoxicilina, tales como: Staphylococcus spp, Streptococcus spp, Bordetella bronchiseptica, Pasteurella multocida, Klebsiella spp. Por la combinación con bromhexina se indica en enfermedades que cursen con secreción bronquial donde sea necesario el uso de un mucolitico y expectorante.
Uso en: Caninos.
Presentación: Frasco de 50 ml
LIBRELA 20MG caja con 2 viales
******Envío exclusivo CDMX por ser producto que requiere refrigeración constante*****
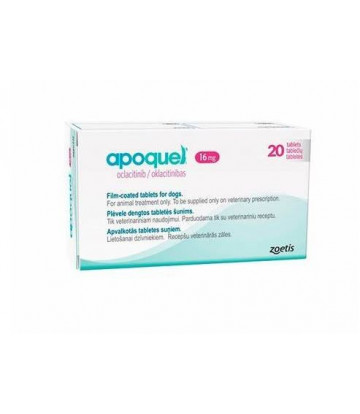
APOQUEL 16mg 20 tabletas
DESCRIPTION
apoquel 16 mg 20 tabletas
FÓRMULA
Apoquel® 16 mg: Cada tableta recubierta con película contiene 16 mg de Oclacitinib (como Maleato de Oclacitinib).
INDICADO EN: Perros
Apoquel: un tratamiento de acción rápida, innovador y seguro para el control de prurito canino agudo y crónico.
INDICACIONES: Para el control del prurito asociado con Dermatitis Alérgica y control de la Dermatitis Atópica en perros a partir de los 12 meses de edad.
Dosificación:
- La dosis de los comprimidos de Apoquel es 0.4 a 0.6 mg.
- Apoquel debe ser administrado dos veces al día (BID) hasta por 14 días de terapia y una vez al día (SID) de ahí en adelante para mantenimiento.
- Apoquel puede ser administrado con o sin alimento.
Brinda un inicio del alivio en 4 horas sin muchos de los efectos secundarios comúnmente asociados con esteroides.
Seguro a corto y largo plazoy puede ser usado con muchos medicamentos comunes.
Dirigido de manera única para detener el prurito con un mínimo de impacto negativoen la función inmune.
Permite diagnosticar la causa subyacente y mejorar la calidad de vida del perro y su propietario.
No use Apoquel en perros menores de 12 meses de edad o con infecciones serias.
ARTRODOL SUSPENSIÓN ORAL 20 ML
DESCRIPTION
ARTRODOL
Reg SAGARPA Q-1190-066
Antagonista del NMDA y Antiinflamatorio no Esteroideo (AINE).
USO EN: PERROS
FORMULA:
Cada ml contiene:
Amantadina ………………………………………. 15 mg
Meloxicam ………………………………………… 0.5 mg
Vehículo c.b.p. …………………………………… 1 ml
DESCRIPCION:
Combinación única de activos que permiten dar una terapia efectiva de la enfermedad articular degenerativa. Suspención oral saborizada.
INDICACIONES:
Tratamiento para el dolor crónico ocasionado por enfermedad articular degenerativa (osteoartritis).
DOSIS:
1 ml (Amantadina 3mg por cada Kg. de peso, Meloxicam 0.1 mg por cada Kg. de peso) por cada 5Kg. de peso cada 24 horas. La duración del tratamiento queda a criterio del Médico Veterinario.
VIA DE ADMINISTRACION:
Oral.
ADVERTENCIAS:
- No administrar en caninos que sufren enfermedades cardiacas, hepáticas, renales, úlcera gástrica o cuando exista sensibilidad al producto.
- Evitar su uso en animales deshidratados, hipovolémicos o hipotensos, preñados o en periodo de lactancia y menores de 6 semanas de edad.
- No se deje al alcance de los niños.
- Conservar a temperatura no mayor a 30ºC, en un lugar fresco, seco y protegido de la luz.
- Producto de uso exclusivo en medicina veterinaria
PRESENTACIÓN:
Frasco con 20 ml.
Uso Veterinario.
Consulte al Médico Veterinario.
Su venta requiere receta médica.